Bạn có từng bối rối khi phân biệt oxide acid và oxide base trong bài học hóa? Hiểu đúng bản chất của chúng là chìa khóa để giải bài tập và ứng dụng trong đời sống, từ sản xuất công nghiệp đến xử lý nước thải. Bài viết này sẽ hướng dẫn bạn cách phân biệt oxide acid và oxide base thật dễ hiểu, kèm phản ứng minh họa và mẹo ghi nhớ nhanh chóng, giúp việc học hóa trở nên nhẹ nhàng hơn.
Oxide Acid là gì? Đặc điểm, phản ứng và ứng dụng thực tế
Oxide acid thường là các oxide của phi kim hoặc một số oxide kim loại có số oxi hóa cao. Đây là những chất khi tan trong nước sẽ tạo thành acid tương ứng. Ví dụ điển hình gồm CO₂, SO₂, SO₃, N₂O₅, P₂O₅. Đối với kim loại có số oxi hóa cao, có thể kể đến CrO₃, Mn₂O₇ như những trường hợp đặc biệt.
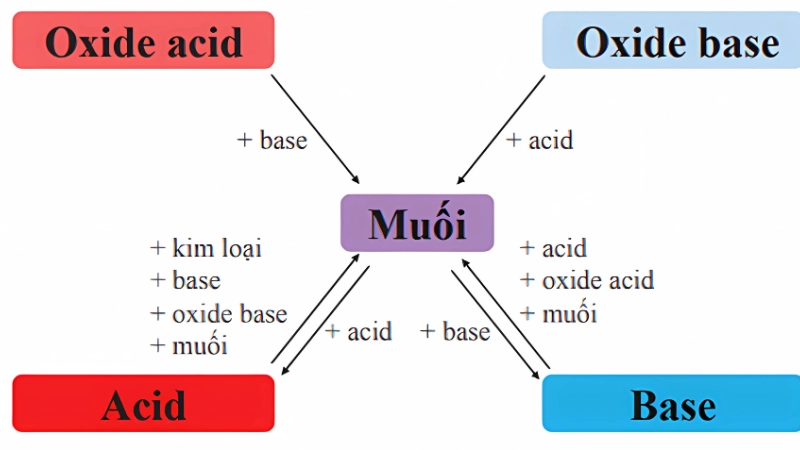
Về tính chất hóa học, oxide acid phản ứng với nước để tạo thành dung dịch acid. Ví dụ CO₂ hòa tan trong nước tạo thành H₂CO₃. Chúng cũng phản ứng với dung dịch base để tạo thành muối và nước, như CO₂ phản ứng với NaOH để tạo Na₂CO₃. Ngoài ra, oxide acid còn có thể phản ứng với một số oxide base để tạo thành muối, điển hình là CO₂ và CaO tạo thành CaCO₃.

Trong đời sống, ta bắt gặp CO₂ trong nước giải khát có gas, hoặc các khí thải như SO₂, NO₂ là nguyên nhân gây ra mưa acid. Những phản ứng này minh chứng cho tính chất oxide acid trong tự nhiên và công nghiệp.
>>>Khám phá thêm: Cách phân biệt nhóm máu của mình đơn giản và hiệu quả
Oxide Base là gì? Định nghĩa, tính chất và ví dụ chi tiết
Oxide base thường là oxide của kim loại. Các kim loại mạnh như Na, K, Ca, Ba tạo ra các oxide Na₂O, K₂O, CaO, BaO. Ngoài ra, còn có oxide của kim loại trung bình và yếu như Fe₂O₃, CuO, ZnO, Al₂O₃ (trong đó Al₂O₃ là oxide lưỡng tính).
Tính chất hóa học của oxide base thể hiện rõ khi chúng phản ứng với nước. Chỉ các oxide kim loại kiềm và kiềm thổ tan trong nước tạo thành base tương ứng, ví dụ CaO+H₂O→Ca(OH)₂. Chúng cũng phản ứng với dung dịch acid để tạo muối và nước, như CuO+HCl→CuCl₂+H₂O. Ngoài ra, oxide base còn có thể phản ứng với oxide acid để tạo muối, chẳng hạn CaO+SO₂→CaSO₃.
Trong đời sống và công nghiệp, CaO được dùng trong sản xuất vôi, xử lý nước thải, còn Fe₂O₃ là thành phần của gỉ sét trên bề mặt sắt. Hiểu rõ đặc điểm này giúp chúng ta ứng dụng hiệu quả và an toàn hơn.

Các phương pháp phân biệt oxide acid và oxide base
Để nhận biết và phân loại chính xác oxide acid và oxide base, chúng ta có thể dựa vào nhiều tiêu chí khác nhau từ thành phần nguyên tố đến phản ứng hóa học.
Phân loại dựa trên Nguyên tố cấu tạo
Một trong những cách đơn giản nhất để phân biệt là dựa vào thành phần nguyên tố. Oxide của phi kim thường là oxide acid, ví dụ CO₂, SO₂. Chúng có xu hướng tạo dung dịch acid khi tan trong nước. Ngược lại, oxide của kim loại thường là oxide base, điển hình như CaO, Na₂O.
Tuy nhiên, cần lưu ý những trường hợp đặc biệt như oxide lưỡng tính (Al₂O₃, ZnO) và oxide trung tính (CO, N₂O) không thuộc rõ rệt vào hai nhóm trên và cần xét thêm phản ứng hóa học để xác định.
Phân biệt bằng Phản ứng hóa học với nước
Phương pháp này rất thực tế và dễ làm trong phòng thí nghiệm. Khi cho oxide phản ứng với nước:
- Nếu dung dịch thu được có tính acid (làm quỳ tím hóa đỏ, phenolphthalein không đổi màu), đó là dấu hiệu của oxide acid. Ví dụ CO₂ + H₂O → H₂CO₃.
- Nếu dung dịch thu được có tính base (làm quỳ tím hóa xanh, phenolphthalein chuyển hồng), chứng tỏ là oxide base, như CaO + H₂O → Ca(OH)₂.
- Nếu oxide không phản ứng với nước, đó có thể là oxide base yếu, oxide trung tính hoặc oxide lưỡng tính. Những trường hợp này cần xét thêm phản ứng với acid hoặc base để phân loại chính xác.
Phân biệt bằng Phản ứng hóa học với dung dịch Acid/Base
Phản ứng với acid hoặc base mạnh là tiêu chí phân biệt quan trọng.
- Oxide acid phản ứng với dung dịch base mạnh để tạo muối và nước. Ví dụ CO₂ + 2NaOH → Na₂CO₃ + H₂O.
- Oxide base phản ứng với dung dịch acid mạnh tạo muối và nước. Ví dụ CuO + 2HCl → CuCl₂ + H₂O.
- Đặc biệt, oxide lưỡng tính có thể phản ứng với cả acid và base mạnh, như Al₂O₃ tan được trong cả HCl và NaOH.
Bảng so sánh chi tiết
Để dễ nhớ và dễ tra cứu, nên tổng hợp thông tin trong một bảng so sánh. Bảng có thể chia rõ các tiêu chí: nguyên tố cấu tạo, khả năng tác dụng với nước, phản ứng với acid, phản ứng với base và ví dụ điển hình. Việc trình bày dạng bảng giúp học sinh, sinh viên dễ học, dễ tra cứu, đồng thời hỗ trợ tốt cho hiển thị trên các công cụ tìm kiếm.
Những trường hợp đặc biệt cần lưu ý
Ngoài hai nhóm chính là oxide acid và oxide base, trong hóa học còn có một số loại oxide đặc biệt mà chúng ta cần nhận biết rõ để tránh nhầm lẫn khi phân loại. Những oxide này có tính chất riêng biệt và không tuân theo quy luật phân biệt thông thường.
Oxide trung tính
Oxide trung tính là những chất không phản ứng với nước, không tác dụng với acid hay base. Chúng gần như “trơ” trong những điều kiện thường gặp trong phòng thí nghiệm. Ví dụ điển hình là CO, NO và N₂O. Khi gặp những oxide này, ta không thể phân loại chúng là acid hay base vì chúng không tạo ra muối cũng không thay đổi độ pH dung dịch.
Oxide lưỡng tính
Một nhóm quan trọng khác là oxide lưỡng tính, đây là các oxide có khả năng phản ứng được cả với acid lẫn base mạnh để tạo muối và nước. Ví dụ như Al₂O₃, ZnO, Cr₂O₃, PbO và SnO₂. Tính lưỡng tính khiến chúng không thể xếp gọn vào nhóm oxide acid hay base thuần túy. Việc nhận biết được oxide lưỡng tính giúp chúng ta dự đoán và điều khiển phản ứng hóa học chính xác hơn.
Oxide không tạo muối
Một số oxide còn có tính chất đặc biệt khác như không tạo muối trong phản ứng thông thường. Ví dụ điển hình là H₂O₂ (hydrogen peroxide). Chất này tham gia phản ứng oxi hóa-khử nhưng không tạo muối như các oxide acid hay base.
Tầm quan trọng của việc nhận biết
Việc hiểu rõ và phân biệt được các trường hợp đặc biệt này rất quan trọng trong học tập và ứng dụng thực tế. Nó giúp tránh nhầm lẫn trong khi viết phương trình phản ứng, thiết kế thí nghiệm và giải các bài tập hóa học, đồng thời mở rộng kiến thức về sự đa dạng của các hợp chất trong tự nhiên và công nghiệp.
>>>Khám phá thêm: Đừng ăn nhầm! Cách phân biệt nấm độc và nấm thường
Phân biệt oxide acid và oxide base không còn khó khăn nếu bạn nắm vững nguyên tắc và phản ứng đặc trưng. Việc hiểu rõ hai nhóm oxide này giúp bạn tự tin khi làm bài tập, thí nghiệm và ứng dụng thực tế. Hãy luyện tập thường xuyên và áp dụng các mẹo học nhanh để ghi nhớ lâu. Mong rằng kiến thức chia sẻ sẽ hỗ trợ bạn chinh phục hóa học thật dễ dàng và hiệu quả.