Hiểu rõ cách phân biệt acid mạnh yếu là kiến thức quan trọng trong hóa học giúp giải bài tập và ứng dụng thực tế hiệu quả. Việc nắm chắc tiêu chí phân ly, giá trị Ka, pH dung dịch sẽ giúp bạn tự tin phân loại chính xác. Bài viết này sẽ hướng dẫn chi tiết và dễ hiểu để bạn nắm vững phương pháp nhận biết acid mạnh, acid yếu nhanh chóng và chính xác nhất.
Định nghĩa acid mạnh và acid yếu
Để hiểu cách phân biệt acid mạnh và acid yếu, bạn cần nắm chắc định nghĩa cơ bản.
Acid mạnh là acid điện ly gần như hoàn toàn trong dung dịch nước. Nghĩa là gần 100% phân tử acid bị phân ly thành ion H+ và anion gốc acid. Ví dụ tiêu biểu là HCl, HNO₃, H₂SO₄ (ở nồng độ loãng).
Acid yếu chỉ phân ly một phần trong nước. Phần lớn phân tử vẫn ở dạng chưa phân ly. Một số ví dụ phổ biến gồm axit axetic (CH₃COOH), axit cacbonic (H₂CO₃), axit xianhydric (HCN).
Điểm mấu chốt trong cách phân biệt acid mạnh yếu là mức độ phân ly: acid mạnh phân ly gần hoàn toàn trong nước, còn acid yếu chỉ phân ly một phần và tồn tại cân bằng động giữa dạng phân tử và ion.
>>>Tìm hiểu thêm: Cách phân biệt some và any trong tiếng Anh chi tiết nhất
Các tiêu chí nhận biết và cách phân biệt acid mạnh yếu
Để xác định cách phân biệt acid mạnh và acid yếu, bạn có thể dựa trên nhiều tiêu chí sau.
Phân ly trong nước
Đây là tiêu chí cơ bản nhất và dễ nhớ nhất. Acid mạnh gần như phân ly hoàn toàn. Ví dụ HCl phân ly hoàn toàn thành H+ và Cl−. Acid yếu chỉ phân ly một phần, thiết lập cân bằng động. Ví dụ CH₃COOH ⇌ H+ + CH₃COO−.
Hằng số phân ly acid (Ka)
Ka phản ánh mức độ phân ly. Acid mạnh thường có Ka rất lớn, đôi khi không đo được chính xác vì phân ly gần như hoàn toàn. Acid yếu có Ka nhỏ hơn rất nhiều và giá trị này thường được tra trong bảng. Ví dụ Ka của axit axetic khoảng 1.8 × 10⁻⁵. Nếu muốn so sánh nhanh, pKa = -log(Ka) cũng là chỉ số phổ biến. pKa càng nhỏ thì acid càng mạnh.
Độ pH dung dịch
Cùng nồng độ, dung dịch acid mạnh luôn có pH thấp hơn acid yếu. Ví dụ dung dịch 0.1M HCl có pH xấp xỉ 1, trong khi 0.1M axit axetic có pH khoảng 2.9. Đây là một phương pháp thực nghiệm quan trọng trong cách phân biệt acid mạnh yếu.
Độ dẫn điện
Acid mạnh phân ly hoàn toàn sinh nhiều ion tự do nên dung dịch dẫn điện rất tốt. Acid yếu có ít ion tự do hơn nên độ dẫn điện kém hơn. Trong thí nghiệm, bạn có thể sử dụng đèn báo độ dẫn điện hoặc máy đo điện trở suất để kiểm tra và so sánh.
Danh sách acid mạnh và acid yếu phổ biến
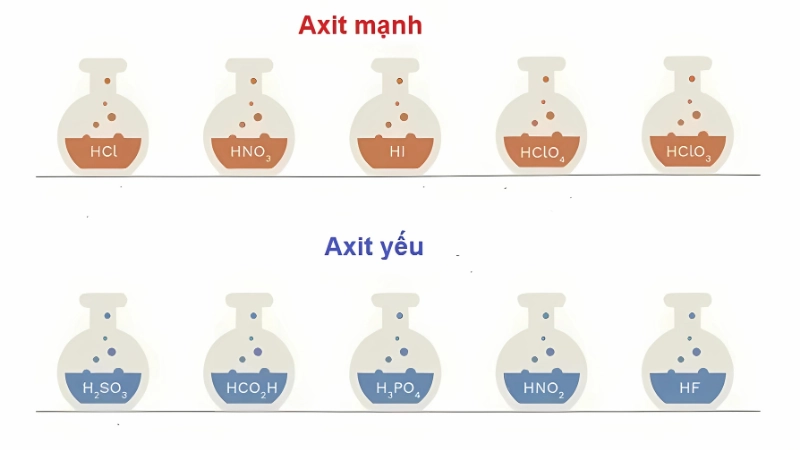
Khi học cách phân biệt acid mạnh acid yếu, việc ghi nhớ một số acid điển hình là rất hữu ích. Acid mạnh thường gặp: HCl, HBr, HI, HNO₃, H₂SO₄ (loãng), HClO₄. Acid yếu thường gặp: HF, H₂CO₃, HCN, CH₃COOH, H₃PO₄. Việc nhớ các ví dụ cụ thể giúp bạn dễ dàng phân biệt trong bài tập và trong thực tế.

Hướng dẫn phân biệt acid mạnh và acid yếu trong thực hành
Ngoài lý thuyết, để áp dụng được cách phân biệt acid mạnh và yếu, bạn cần biết phương pháp thực hành cụ thể.
Bước 1: Kiểm tra công thức và tên gọi
Bạn nên tra cứu bảng phân loại acid để biết trước chất đó là mạnh hay yếu. Thông thường, acid vô cơ một nấc như HCl, HNO₃ là acid mạnh. Nhiều acid hữu cơ như axit cacboxylic (CH₃COOH) là acid yếu.
Bước 2: Tra cứu ka hoặc pKa
Giá trị Ka hoặc pKa rất hữu ích trong phân biệt. Ka lớn chứng tỏ acid mạnh. pKa nhỏ hơn nghĩa là acid mạnh hơn. Bạn có thể dễ dàng tìm thấy các giá trị Ka hoặc pKa trong các bảng hóa học chuẩn.
Bước 3: Đo pH dung dịch
Phương pháp phổ biến và trực quan nhất là đo pH. Dung dịch acid mạnh cùng nồng độ sẽ có pH thấp hơn acid yếu. Thí nghiệm đo pH giúp xác định và so sánh một cách định lượng.
Bước 4: Đo độ dẫn điện
Kiểm tra độ dẫn điện cũng là cách thực nghiệm quan trọng. Dung dịch acid mạnh dẫn điện tốt hơn do nồng độ ion cao. Dùng thiết bị đo độ dẫn điện hoặc đèn báo đơn giản để so sánh hai dung dịch.
Ứng dụng kiến thức phân biệt acid mạnh yếu
Sau khi nắm vững cách phân biệt acid mạnh và yếu, bạn có thể áp dụng để:
- Tính pH dung dịch.
- Tính nồng độ ion H+.
- Viết phương trình điện ly đúng.
- Giải các bài toán cân bằng axit–bazơ.
- Dự đoán hướng phản ứng trao đổi ion.

Mở rộng cách phân biệt acid base mạnh yếu
Ngoài cách phân biệt acid mạnh yếu, nhiều người cần học thêm cách phân biệt acid base mạnh yếu để làm bài tập và hiểu bản chất phản ứng axit–bazơ. Đây là bảng so sánh ngắn gọn:
| Thuộc tính | Acid mạnh | Acid yếu | Base mạnh | Base yếu |
| Mức độ phân ly | Gần như hoàn toàn | Phân ly một phần | Gần như hoàn toàn | Phân ly một phần |
| Ví dụ | HCl, HNO₃, H₂SO₄ | CH₃COOH, HF | NaOH, KOH | NH₃, Mg(OH)₂ |
| Ka hoặc Kb | Ka lớn | Ka nhỏ | Kb lớn | Kb nhỏ |
| pH/pOH dung dịch | pH rất thấp (acid mạnh) | pH cao hơn (acid yếu) | pOH rất thấp (base mạnh) | pOH cao hơn (base yếu) |
| Độ dẫn điện | Cao | Thấp hơn | Cao | Thấp hơn |
Cách phân biệt acid base mạnh yếu thường dựa trên:
- Tra cứu Ka, Kb, pKa, pKb.
- Độ pH/pOH dung dịch.
- Mức độ dẫn điện.
- Tên chất và công thức.
Khi đã hiểu cách phân biệt acid mạnh và yếu, bạn chỉ cần áp dụng tương tự cho base. Base mạnh phân ly hoàn toàn (NaOH → Na⁺ + OH⁻), base yếu phân ly một phần (NH₃ + H₂O ⇌ NH₄⁺ + OH⁻).
>>>Tìm hiểu thêm: Cách phân biệt vàng và đồng nhanh như dân trong nghề
Nắm vững cách phân biệt acid mạnh yếu không chỉ giúp bạn học tốt hóa học mà còn vận dụng hiệu quả trong thực tế và công nghiệp. Từ mức độ phân ly, giá trị Ka đến pH dung dịch, mỗi tiêu chí đều hỗ trợ bạn xác định chính xác acid mạnh hay yếu. Hãy áp dụng kiến thức này để tự tin giải bài tập và hiểu sâu bản chất phản ứng axit–bazơ.